Уравнение на Арениус
Уравнението на Арениус установява зависимостта на скоростта на дадена химична реакция от температурата. Уравнението е формулирано от Сванте Арениус през 1889 г. на базата на работата на Якоб Вант Хоф, който през 1884 г. отбелязва, че уравнението на Вант Хоф за температурна зависимост на равновесната константа предполага и формула за скоростта на реакциите в която и да е посока. Това уравнение има широко и важно приложение при определянето на скоростта на химичните реакции и за изчисляване на енергията на активация. Арениус предоставя физическата обосновка и интерпретация на формулата.[1][2][3] В днешно време, тя се разглежда най-вече като емпирична връзка. Може да се използва за моделиране на температурното изменение на коефициентите на дифузия, популацията на свободните кристални места и много други термично предизвикани процеси и реакции.
Уравнение
[редактиране | редактиране на кода]

Уравнението на Арениус дава зависимостта на константата на скоростта на химична реакция спрямо абсолютната температура, фактор на честотата и други константи на реакцията:
където
- k е константата на скоростта;
- T е абсолютната температура (в келвини);
- A е фактор на честотата (честотата на сблъсъците в правилната ориентация);
- Ea е енергията на активация на реакцията;
- R е универсалната газова константа.[1][2][3]
Също така, уравнението може да се запише като:
където
- Ea е енергията на активация на реакцията;
- kB е константата на Болцман.
Единствената разлика между двете е мерната единица за енергия на Ea – първото използва енергия на мол (по-често срещано в химията), докато второто използва енергия на молекула (по-често срещано във физиката).
Мерните единици на фактора на честотата A са същите като тези на константата на скоростта на реакцията и зависят от реда на реакцията. Ако е от първи ред, тя има мерни единици s−1. k е най-просто броят сблъсъци, които водя до реакция на секунда, A е общият брой сблъсъци (независимо дали водят до реакция или не) на секунда в правилната ориентация,[4] а е вероятността който и да е сблъсък да доведе до реакция. Може да се види, че или увеличаването на температурата, или намаляването на енергията на активация (например чрез използването на катализатор) би довело до увеличаване на скоростта на реакцията.
Също така, разумно е да се допусне, че енергията на активация не зависи от температурата. По подобен начин, в множество практически случаи, слабата температурна зависимост на фактора на честотата е пренебрежимо малка в сравнение с температурната зависимост на , освен в случая на реакциите, ограничени от дифузия, при които факторът на честотата е преобладаващ и пряко наблюдаем.
Графика
[редактиране | редактиране на кода]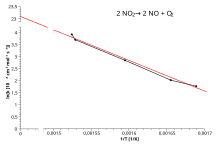
Извеждането на естествен логаритъм от уравнението на Арениус дава:
Горното може да се преподреди като:
Това има същия вид като уравнение за права отсечка:
където x е реципрочно на T.
Оттук следва, че когато дадена реакция има константа на скоростта, която се подчинява на уравнението на Арениус, съставянето на графика на ln k спрямо T−1 дава права отсечка, чийто градиент и прекъсване може да се използват за определяне на Ea и A. Тази процедура е широко разпространена в експерименталната химична кинетика и химиците я използват за извеждане на енергията на активация на реакциите чрез:
Източници
[редактиране | редактиране на кода]- ↑ а б Arrhenius, S. A. Über die Dissociationswärme und den Einfluß der Temperatur auf den Dissociationsgrad der Elektrolyte // Z. Phys. Chem. 4. 1889. DOI:10.1515/zpch-1889-0408. с. 96 – 116.
- ↑ а б Arrhenius, S. A. Über die Reaktionsgeschwindigkeit bei der Inversion von Rohrzucker durch Säuren // Z. Phys. Chem. 4. 1889. DOI:10.1515/zpch-1889-0116. с. 226 – 248.
- ↑ а б Keith J. Laidler (1987) Chemical Kinetics, Third Edition, Harper & Row, p. 42
- ↑ Silberberg, Martin S. Chemistry. 4. NY, McGraw-Hill, 2006. ISBN 0-07-111658-3. с. 696.










![{\displaystyle E_{\rm {a}}\equiv -R\left[{\frac {\partial \ln k}{\partial (1/T)}}\right]_{P}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d79cf5cbb3009fb526eb1c5fa2a719f5432f6748)